Barrueta-Acevedo, FM
Resumen
La estasis post-ovulatoria es un síndrome reproductivo comúnmente visto en reptiles mantenidos en cautiverio. Las causas son numerosas y a menudo multifactoriales. La ausencia de una dieta adecuada, temperaturas ambientales menores a las óptimas, estrés por manipulación, fuentes inapropiadas de luz y sitios de anidación inadecuados, son algunas de las causas más comunes de retención de huevos en reptiles en cautiverio; enfermedades locales o sistémicas pueden también conducir a estasis ovulatoria. El tiempo gravidez depende de la especie. Una hembra grávida a menudo dejará de comer por un periodo de 3 a 4 semanas antes de la puesta, pero permanecerá activa. Un cambio en el comportamiento y agitación puede ocurrir cuando el animal está buscando un sitio para anidar. Una hembra grávida, tranquila y deprimida, indica un problema. La pérdida de peso o masa muscular puede evidenciarse sobre la pelvis, hombros y extremidades. El abdomen puede distenderse dramáticamente, y los huevos a menudo son palpables en el abdomen o visibles en la pared corporal. Las radiografías revelarán espacios ocupados por masas lobuladas en el abdomen caudal. La calcificación de los huevos puede verse en caso de estasis post-ovulatoria. Si la estasis no responde a la corrección de los factores medioambientales o de la dieta; o cuando el uso de oxitocina es inapropiado o no responsivo, la cirugía debe ser considerada. El presente artículo muestra el caso de una pitón reticulada con estasis post ovulatoria, su diagnóstico, tratamiento y evolución.
Palabras clave: estasis post-ovulatoria, salpingotomía, distocia, pitón reticulada, Malayopython reticulatus.
Abstract
Post ovulatory egg stasis is a common reproductive syndrome in captive reptiles. The causes are numerous and often multifactorial. Lack of proper diet, less than optimal environmental temperatures, handling stress, improper light sources and inadequate nesting sites are some of the common causes of egg stasis in captive reptiles. Local or systemic disease may also lead to egg stasis. The gravidity time is depending on the specie. Gravid female will often stop eating for a 3-4 week period prior to egg laying, but remain active. A change in behavior and restlessness may occur as the reptile seeks a nesting site. A quiet, depressed, gravid female indicates a problem. Loss of weight or muscle mass may be evident over the pelvis, shoulders and limbs. The abdomen may distend dramatically, and eggs will often be palpable in the abdomen or visible on the body wall. Radiographs will reveal lobulated space-occupying masses in the caudal abdomen. Calcification of eggs may be visible in case of post-ovulatory egg stasis. If egg stasis falls to respond to correction of environmental or dietary factors or the use of oxytocin is inappropriate or is appropriate but nonresponsive, surgery should be pursued. The present article describes the clinical report of a reticulated pythotn whit postovulatory stasis, it diagnosis, treatment and evolucion.
Key words: post-ovulatory stasis, salpingotomy, dystocia, reticulated python, Malayopython reticulatus
Introducción
Con la llegada de la estación reproductiva, en los ovarios de las hembras que están sanas y en buena condición corporal, comienza la maduración de los folículos. Esta maduración consiste, fundamentalmente, en un aumento del tamaño de los óvulos debido a la incorporación del vitelo a su citoplasma. Se pasa así de un folículo inmaduro de unos cuantos milímetros de diámetro a un folículo maduro de varios centímetros. Al completarse la maduración del folículo se produce la ovulación, pasando éste al oviducto.
En caso de realizarse la cópula es en el oviducto donde se produce la fecundación y donde el huevo adquiere sus cubiertas protectoras (membrana previtelina, albúmina, cáscara y cutícula). El ciclo se cierra con la puesta de los huevos. En el caso de los reptiles, las puestas suelen ser múltiples. De este modo, el ciclo reproductivo de la mayoría de los reptiles, podría resumirse de la siguiente forma: desarrollo folicular, ovulación, fecundación, formación de los huevos y puesta.
Sin embargo, en cautiverio, una de las distocias más frecuentes, es la estasis postovulatoria; aquí sí se produce la ovulación. Los óvulos pasan al oviducto, adquieren todas o alguna de las cubiertas protectoras, pero no se produce la puesta. Los huevos estancados en el oviducto crean un problema mecánico por compresión de las vísceras vecinas: dificultan el retorno venoso al corazón, ocluyen la luz intestinal, no permitiendo la ingesta de alimento, son causa de disnea, la rotura de alguno de los huevos puede provocar una seria infección, etc. Si no se actúa a tiempo, el desenlace será la muerte del animal.
El 10% de los reptiles en cautividad sufren distocias anualmente, el 42% ocurren en serpientes, siendo más común en ovíparas que en vivíparas. Las hembras primerizas y las que han tenido alguna distocia previa tienen predisposición a sufrir distocias. El huevo retenido pocas veces es fértil, sin embargo los huevos extraídos por oxitocina, pero que no estaban retenidos, sí pueden incubarse. Se han obtenido fetos viables a partir de salpingotomía. El pronóstico de supervivencia y fertilidad es favorable normalmente, aunque predispone a futuras distocias.
Etiología
Aunque en muchos casos resulta complicado determinar la causa, intentar descubrirla nos puede ayudar a corregir el problema y a intentar prevenirlo en el futuro.
Podemos diferenciar las distocias en dos tipos:
–Obstructivas
Resultan de la imposibilidad de expulsar uno o más huevos a través del oviducto y cloaca. La causa suele deberse a una malformación o tamaño excesivo del huevo, o a anomalías maternas, como alteraciones en la estructura de la pelvis, anormalidades en el oviducto, como tumores, abscesos intra y extraluminales, fecalomas o cuerpos extraños en colon y recto o cálculos urinarios. Además, puede ser también consecuencia de una complicación durante la ovoposición, como fallo del posicionamiento de los huevos o ruptura de estos.
–No obstructivas
Una gran cantidad de distocias vienen causadas por deficiencias en el manejo, tales como falta de exposición a luz solar, factores nutricionales (deficiencias de calcio, animales muy delgados u obsesos), temperatura, hábitat, deshidratación, o una mala condición física. Esto último es frecuente en hembras en cautividad, pues además del manejo inadecuado, hacen menos ejercicio y poseen menos tono muscular. Esta causa es frecuente cuando son capaces de expulsar todos salvo uno o dos y el huevo es aparentemente normal. Se suelen hallar distintos microorganismos en las distocias, pero no está claro si causan ellos la distocia o si invaden beneficiándose de la misma, causando salpingitis.
Si se observa que tras el periodo normal de gravidez del reptil, este no ha desovado o lo intenta pero es difícil, se deben corregir los siguientes factores:
• Mantener al reptil a una temperatura adecuada para la especie.
• Si está en mal estado será necesario estabilizarla mediante la administración de fluidos y suplementos vitamínicos o minerales.
• Si está en buen estado debe administrarse calcio vía intramuscular durante dos o tres días; y seis horas después de la última inyección, provocar la puesta mediante la administración de oxitocina vía intramuscular. En condiciones normales la puesta debe completarse en un par de horas. Es importante tener presente que nunca hay que inyectar oxitocina como primera opción, ya que conlleva riesgos tales como desgarros en la pared del oviducto, prolapsos de oviducto, etc. Los resultados de todos modos no siempre suelen ser positivos, y algunas especies no responden de manera adecuada a la oxitocina.
• La cirugía únicamente debe realizarse tras un correcto diagnóstico de estasis folicular y en el caso de una estasis postovulatoria que no responde al tratamiento médico. Antes de cualquier intervención siempre es recomendable la extracción de sangre para conocer el estado del paciente. Es aconsejable realizar un hemograma y valorar las funciones renal y hepática. Es conveniente administrar antibióticos antes de la cirugía de manera profiláctica.
Si el tamaño del paciente lo permite, lo ideal es suturar la capa muscular y la piel de forma independiente. Tras comprobar que no hay hemorragias se procede a cerrar la incisión cutánea. Debido a la presencia de las escamas, en los reptiles la piel debe suturarse siguiendo un patrón de eversión. Los puntos se quitan al cabo de 30 días.
La herida debe revisarse cada 7 días. En el terrario deben retirarse las ramas y elementos que puedan causar lesiones en el sitio de incisión. El sustrato puede ser de papel periódico atóxico o cartón y debe cambiarse a diario. Deben retirarse los recipientes profundos con agua, puesto que la herida maceraría y los puntos de sutura acabarían por soltarse. La herida quirúrgica debe mantenerse limpia y ventilada.
Después de la intervención hay que administrar antibióticos durante 10 días y analgésicos durante 3-5 días. Dado que tras la operación los pacientes suelen dejar de comer durante 2 - 3 días, debemos aportarles una alimentación rica en agua, vitaminas y nutrientes.
Diagnóstico
En serpientes, lo más frecuente es la retención del último o dos últimos huevos, pero que tras extraerlos tienen apariencia normal (puede deberse a la debilidad muscular). El diagnóstico se basa en historia previa de ovoposición y la visualización de una masa caudal en especies ovíparas. Debido al gran diámetro de las pitones, es difícil la detección visual del huevo retenido, por lo que es imprescindible el diagnóstico por palpación o equipo de imagenología. La gravidez en serpientes es larga y la predicción del momento del parto es difícil, por lo que detectar problemas en la puesta es difícil. El esfuerzo prolongado y prolapso de cloaca son indicativos de dificultad de paso del huevo.
Tratamiento
Una de las maneras de solucionar la retención en serpientes de talla pequeña, es empujar los huevos con un dedo a lo largo del vientre de la serpiente. Sin embargo, es posible provocar la ruptura o prolapso del oviducto, o incluso la muerte del animal con este manejo, por lo que no es recomendable su aplicación. Si el huevo asoma por la cloaca, podremos usar este método para terminar de sacarlo, pero podemos causar la ruptura de huevos e incluso la muerte, por lo que se debe aplicar con mucho cuidado.
Una de las maneras de solucionar la retención en serpientes de talla pequeña, es empujar los huevos con un dedo a lo largo del vientre de la serpiente. Sin embargo, es posible provocar la ruptura o prolapso del oviducto, o incluso la muerte del animal con este manejo, por lo que no es recomendable su aplicación. Si el huevo asoma por la cloaca, podremos usar este método para terminar de sacarlo, pero podemos causar la ruptura de huevos e incluso la muerte, por lo que se debe aplicar con mucho cuidado.
La primera elección en tratamiento suele ser la de administrar hormonas pituitarias para estimular contracciones del oviducto como la oxitocina. Se suele dar una segunda dosis de oxitocina a los 20-60 minutos. Como el efecto de la oxitocina se ve influenciado por la temperatura, habrá que mantener al paciente en su temperatura corporal ideal antes de la administración de la misma. La oxitocina es más efectiva en las primeras 48 horas de distocia, sobre todo en serpientes, en las que la efectividad disminuye un 50% tras este periodo.
La arginina-vasotocina es un análogo natural de la oxitocina al cual se ha demostrado que es diez veces más sensible el oviducto, pero es difícil de conseguir, cara e inestable. Se administra 0.01-1 µg/kg vía intramuscular o intracelómica. Estos dos fármacos aumentan la contractilidad del oviducto, por lo que están contraindicados en distocias obstructivas, en las cuales pueden causar desde la ruptura del huevo hasta la muerte del animal. Si observamos contracciones en el paciente, pero que es incapaz de expulsar el huevo, no debemos administrar ni oxitocina ni arginina-vasotocina.
La ovocentesis percutánea en serpientes permitirá que el huevo disminuya de tamaño al extraer la yema de su interior, pero debemos tener cuidado de no contaminar la cavidad celómica con el contenido del huevo. De esta forma, le será más fácil expulsar el cascarón. La aspiración se debe realizar lo antes posible para evitar que el contenido del huevo solidifique y consigamos extraerlo. La ovoposición se llevará a cabo en las próximas horas tras realizar la aspiración, aunque puede durar hasta 48 horas posteriores. Para acelerar el proceso de ovoposición tras aspiración, puede administrarse oxitocina. Si no expulsa el huevo en las 48 horas posteriores a la aspiración, se aconseja la cirugía de extracción del huevo para evitar posibles infecciones o peritonitis por la posible salida del contenido del huevo a través del orificio en la cáscara. Este método se puede usar también cuando el huevo asoma por la cloaca, facilitando su salida, incluso extrayéndola mecánicamente.
La cirugía es otra de las opciones. Para ello es necesaria la anestesia, que además facilitará la relajación del oviducto y por tanto la palpación y posible extracción manual de huevo (cuidado con causar prolapso y ruptura). Dependiendo del estado del oviducto y tejidos adyacentes, se realizará salpingotomía simple o múltiple, salpingectomía unilateral o bilateral u ovariosalpingectomía unilateral o bilateral. No se podrá garantizar la supervivencia o futura reproducción del paciente hasta después de la cirugía. La intervención se suele realizar 1 o 2 filas de escamas por encima del huevo retenido. Se deberán extraer todos los huevos contenidos por la misma incisión o si es necesario realizar nuevas incisiones. El oviducto se cerrará con una sutura absorbible. Si se producen adeherencias o existen daños en los tejidos, hay que extraer todo el tejido reproductor. Sin embargo, suele ser difícil acceder a todo el aparato reproductor. La salpingectomía suele ser habitual en distocias largas y especies ovíparas.
Caso clínico
Es referida al Hospital Veterinario, una pitón reticulada (Malayopython reticulatus), adulta, con historial de copulación en dos temporadas anteriores, sin ovoposición, la cual había mostrado letargo y anorexia. Al examen físico general, se trata de un animal de gran talla, con un peso de 20Kg y una longitud de 2.3 metros, lo que hace imposible la palpación adecuada. Dada la sospecha de estasis post ovulatoria, se realiza ecografía de cavidad celómica, donde pueden observarse masas ovoides, compatibles con la presencia de huevos, así como múltiples masas amorfas en oviducto.
 |
| Ecografía de cavidad celómica que muestra la presencia de masas ovales en oviducto |
 |
| Ecografía. Detalle |
Se proporcionan las condiciones adecuadas de humedad y temperatura y se espera mejoría durante 24 horas. Al no haber respuesta a las condiciones medioambientales, se administra oxitocina (2UI/Kg), no obteniéndose resultados satisfactorios, por lo que se decide realizar salpingotomía para la extracción de los huevos.
Se realiza la inducción anestésica mediante la inyección intramuscular de tiletamina/zolazepam (20mg/Kg), y se continúa el mantenimiento con isoflurano.
 |
| Administración de tiletamina/zolacepam para inducción de la anestesia |
 |
| Mantenimiento de la anestesia vía tubo endotraqueal con isoflurano |
El animal es canalizado en vena palatina derecha, por donde es administrada la fluidoterapia (solución UNO) durante el procedimiento. Se administra enrofloxacina (5mg/Kg) y meloxicam (200mcg/Kg) por vía intramuscular y se comienza el procedimiento quirúrgico.
 |
| Canalización en vena palatina |
Se realiza asepsia del área empleando yodopovidona y se accede a la cavidad celómica mediante una incisión paramedial izquierda, en la unión de las escamas ventrales y laterales, utilizando bisturí para la piel y profundizando mediante disección roma de la capa muscular.
 |
| Asepsia del área quirúrgica |
 |
| Sitio de incisión quirúrgica |
 |
| Incisión de la piel |
 |
| Disección roma de la capa muscular |
Una vez en cavidad celómica, se localiza el oviducto, el que es exteriorizado e incidido para retirar su contenido. Se extrajeron más de 20 huevos, muchos de los cuales se encontraban momificados.
 |
| Exposición del oviducto |
 |
| Exteriorización del contenido del oviducto |
 |
| Extracción de los huevos retenidos en el oviducto |
 |
| Huevo extraído durante el procedimiento quirúrgico |
Al concluir la extracción de los huevos del oviducto, este se sutura en dos capas, una interna con patrón continuo invaginante, y una externa con puntos simples.
 |
| Sutura de la capa interna del oviducto, mediante patrón invaginante continuo |
 |
| Sutura de la capa externa del oviducto, mediante patrón con puntos simples |
Se procede a suturar músculo con puntos en "X" y posteriormente se afronta la piel con puntos en "U".
 |
| Sutura del plano muscular con puntos en X |
 |
| Sutura de la piel con puntos en U evaginantes |
 |
| Huevos extraídos del oviducto |
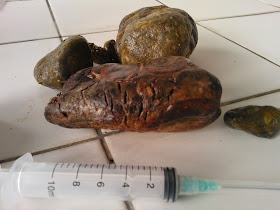 |
| Huevos momificados extraídos del oviducto |
El animal es colocado en un terrario para su recuperación. Se continúa con la administración de enrofloxacina (5mg/Kg SID por 10 días) y meloxicam (200mcg/Kg SID por 3 días) por vía intramuscular. Al día siguiente el ejemplar muestra comportamiento normal.
 |
| Ejemplar en su terrario, 24 horas después del procedimiento quirúrgico |
Bibliografía
Barten SL. 1985. Oviductal Rupture in a Burmese Python (Python-Molurus-Bivittatus) Treated with Oxytocin for Egg Retention. J. Zoo. Anim. Med. 16(4): 141-143.
Bemis DA, Grupka LM, Liamthong S, Folland DW, Sykes JM, Ramsay EC. 2007. Clonal relatedness of Salmonella isolates associated with invasive infections in captive and wildcaught rattlesnakes. Vet. Microbiol. 120(3-4): 300–307.
Brames H. 2007. Aspects of light and reptilian immunity. Iguana: Conservation, Natural History, and Husbandry of Reptiles (International Reptile Conservation Foundation). 14(1): 19–23.
Carpenter JW, editor. 2013. Exotic Animal Formulary. 4th ed. St. Louis (MI): Saunders Elsevier. DeNardo D. 2006. Dystocias. En: Mader DR, editor. Reptile Medicine and Surgery. 2nd ed. USA: Saunders Elsevier. p. 787-792.
Ebani VV, Cerri D, Fratini F, Meille N, Valentini P, Andreani E. 2005. Salmonella enterica isolates from faeces of domestic reptiles and a study of their antimicrobial in vitro sensitivity. Res. Vet. Sci. 78: 117– 121.
Feeley JC, Treger MD. 1969. Penetration of turtle eggs by Salmonella braenderup. Public Health Rep. 84(2): 156–158. Doi: 10.2307/4593527. Gehrmann WH. 2006. Artificial lighting. En: Mader DR. Reptile Medicine and Surgery. 2nd ed. USA: Elsevier Saunders. p. 1081-1084.
Geue L, Löschner U. 2002. Salmonella enterica in reptiles of German and Austrian origin. Vet. Microbiol. 84(1-2): 79–91.
Gibbons PM, Klaphake E, Carpenter JW. 2013. Reptiles. En: Carpenter JW, editore. Exotic Animal Formulary. 4th ed. St. Louis (MI): Saunders Elsevier. p. 84-182.
Hilbert F, Smulders FJM, Chopra-Dewasthaly R, Paulsen P. 2012. Salmonella in the wildlifehuman interface. Food Res. Int. 45(2): 603–608.
Lock BA. 2000. Reproductive surgery in reptiles. Vet. Clin. Exot. Anim. 3(3): 733–752. Mitchell MA. 2004. Snake care and husbandry. Vet. Clin. Exot. Anim. 7(2): 421–446.
Mitchell MA. 2006. Salmonella: Diagnostic methods for reptiles. En: Mader DR, editor. Reptile Medicine and Surgery. 2nd ed. USA: Elsevier Saunders. p. 900-905.
Mitchell MA, Shane SM. 2001. Salmonella in Reptiles. J. Exot. Pet Med. 10(1): 25–35.
Mitchell MA. 2009. Snakes. En: Mitchell MA, Tully TN, editores. 2009. Manual of Exotic Pet Practice. St. Louis (MI): Elsevier Saunders. p. 136-163.
Millichamp NJ, Lawrence K, Jacobson ER, Jackson OF, Bell DA. 1983. Egg retention in snakes. Journal of the American Veterinary Medical Association. 183(11): 1213–1218.
O’Malley B. 2005. General anatomy and physiology of reptiles. En: O’Malley B, editor. Clinical Anatomy and Physiology of Exotic Species: Structure and Function of Mammals, Birds, Reptiles and Amphibians. 1° ed. London (UK): Elsevier Saunders. p. 17-39.
Rivera S. 2008. Health assessmet of the reptilian reproductive tract. J. Exot. Pet Med. 17(4): 259 – 266.
Rojas-Santos L. 2012. Apuntes sobre el abordamiento terapéutico antimicrobiano en reptiles. Mem. Conf. Interna Med. Aprovech. Fauna Silv. Exót. Conv. 8(2): 5–9.
Schumacher J. 2006. Selected infectious diseases of wild reptiles and amphibians. J. Exot. Pet Med. 15(1): 18–24.
Stahl S. 2006. Reptile obstetrics. En: The North American Veterinary Conference. Vol. 20; 2006 jan 7 – 11; Orlando (FL): NAVC. p. 1680–1683.
Sykes JM. 2010. Updates and practical approaches to reproductive disorders in reptiles. Vet. Clin. Exot. Anim. 13(3): 349–373.
No hay comentarios:
Publicar un comentario