La presencia de la genética en la ecología y biología evolutivas no ha dejado de crecer en las últimas décadas. Estudios teóricos, experimentales y empíricos han documentado los cambios genéticos que las poblaciones sufren como consecuencia de la fragmentación y el declive, y han confirmado las consecuencias negativas de éstos sobre la viabilidad poblacional y la evolución adaptativa. La aplicación de éstas técnicas aporta información sobre la historia evolutiva, demografía, ecología y comportamiento de las especies que puede ayudar en la evaluación de riesgos y el diseño de estrategias de conservación eficaces (Godoy, 2009).
La familia de los guepardos comprende un grupo de felinos grandes y delgados, con una morfología dentaria y cráneo distintivo, del cual solamente permanece Acinonyx jubatus (Christiansen & Mazák, 2009). Esta especie es conocida como el animal terrestre más rápido, adaptado para la persecución a grandes velocidades en las llanuras africanas. Posee extremidades alargadas, garras semirretráctiles, un cráneo aerodinámico y músculos cardiacos y glándulas adrenales agrandadas (O´Brien, 1994).
Los guepardos tienen una combinación de patrones de distribución y estructura social única en mamíferos, donde coaliciones de machos ocupan territorios pequeños, de menos de un 10% de los utilizados por hembras solitarias, quienes se aparean con más de un macho durante un ciclo estral (Gottelli et al., 2007).
A principios de 1900, los guepardos (Acinonyx jubatus) se distribuían a través del Sahel de África, Este Medio y la Península Arábiga, hasta India y las provincias del Sur de la Antigua Unión Soviética. Al día de hoy, las poblaciones asiáticas se encuentran cercanas a la extinción, con la población más grande confirmada de menos de 100 animales, habitando el centro de Irán. En África, permanece un estimado de 15,000 individuos, cuyas poblaciones de mayor tamaño se encuentran en Namibia, Botswana, Zimbabwe, Kenia y Tanzania (Marker et al., 2008).
Las poblaciones de guepardos en la actualidad se encuentran altamente amenazadas debido a la pérdida de hábitat, caza furtiva, competencia con otros carnívoros, exterminación masiva para proteger al ganado en áreas no conservadas y al fracaso de su mantenimiento en cautiverio. Los guepardos en cautiverio se reproducen muy poco y tienen una alta prevalencia de enfermedades inusuales que causan morbilidad y mortalidad. Estas enfermedades son raramente observadas en guepardos de vida libre, pero han sido documentadas en individuos capturados y mantenidos en cautiverio temporal o permanentemente (Terio et al., 2004).
El guepardo ha sido considerado como un paradigma de vulnerabilidad a muchas enfermedades, debido a su poca diversidad genética, particularmente en los genes correspondientes al MHC (Tizard, 2009; Castro-Prieto et al., 2011). Sin embargo, los primeros estudios utilizaron métodos con baja resolución para cuantificar la diversidad del MHC, así como pequeños tamaños de muestra. Además, una alta susceptibilidad a enfermedades fue reportada solamente para guepardos en cautiverio, mientras que las poblaciones de vida libre no muestran signos de enfermedades infecciosas y muestran un estado general de salud adecuado (Castro-Prieto et al., 2011).
Generalmente, altos niveles de variabilidad genética son vistos como indicadores de salud, confiriendo la habilidad para responder a distintas amenazas, tales como enfermedades, parásitos y depredadores, así como a cambios en el medio ambiente. Por el contrario, bajos niveles de variabilidad genética, indicarían las limitaciones de la especie para responder a estas amenazas, ya sea a corto o largo plazo (Amos & Harwood, 1998).
Complejo Mayor de Histocompatibilidad
El Complejo Mayor de Histocompatibilidad (MHC) es un grupo de genes estrechamente relacionados entre sí, constituye el componente genético más importante del sistema inmune de los mamíferos, al codificar para las moléculas del MHC (Sommer, 2005).
Las moléculas del MHC desempeñan funciones importantes en el reconocimiento intercelular y la diferenciación de lo propio y lo extraño. Tanto los genes como sus productos, participan en el desarrollo de las respuestas inmunitarias, ya sea humoral o celular. Debido a que las moléculas del MHC son las estructuras responsables de la presentación del antígeno, el grupo particular de estas estructuras que un individuo expresa, influye en el repertorio de antígenos a los que los linfocitos T colaboradores y citotóxicos de este pueden responder (Tizard, 2009).
Importancia de la variabilidad del MHC en la Conservación
Variabilidad genética adaptativa con respecto al impacto humano
El impacto humano (fragmentación, degradación y aislamiento de hábitat, urbanización y contaminación) tiene diversos impactos sobre la ecología y genética de las poblaciones, tanto de vertebrados, como de parásitos. A menudo causa una pérdida de la variación genética, conduciendo a la reducción a corto plazo de los componentes del valor adaptativo, y a la falta de habilidad para adaptarse a cambios medioambientales, lo cual tiene influencia en los resultados evolutivos (Sommer, 2005).
La constitución del MHC puede influenciar la sobrevivencia a largo plazo de pequeñas poblaciones animales, e indica la importancia funcional del mantenimiento de la variabilidad en las poblaciones deterioradas o fragmentadas (Sommer, 2005; Tizard, 2009).
Polimorfismo del MHC: valor adaptativo individual y supervivencia a largo plazo
Se cree que la variación genética en los loci del MHC es importante para la resistencia contra patógenos, incrementando el valor adaptativo y por lo tanto, la supervivencia a largo plazo. Muchos estudios han reportado Resistencia disminuida contra patógenos en homocigotos del MHC, o un incremento en la susceptibilidad a patógenos en individuos endogámicos en general. Sin embargo, una relación directa entre una reducción de la población mediada por patógenos y baja variabilidad del MHC ha sido difícil de demostrar en poblaciones silvestres. Estudios recientes indican que, aunque los alelos del MHC sean bajos en muchas especies que experimentan cuellos de botella, la mayoría aún mantienen un alto grado de divergencia entre alelos (Sommer, 2005).
Los estudios indican que los procesos de selección mantienen el polimorfismo del MHC, incluso bajo condiciones desfavorables, por lo menos durante cierto tiempo, lo que sugiere que niveles de variabilidad en especies con bajo número de alelos del MHC, puede ser suficiente para prevenir un descenso inmediato de la población mediado por patógenos. Sin embargo, en tales poblaciones los procesos adaptativos a las condiciones cambiantes pueden estar limitados (Sommer, 2005).
En lo que concierne al papel del MHC en la genética de la conservación, el papel funcional de los demás genes (no pertenecientes al MHC) en la resistencia a las enfermedades, no debería ser ignorado. Estudios en humanos indican que estos genes pueden jugar un papel importante en la determinación de la resistencia a patógenos y parásitos, ya sea por sí mismos, o por interacción espistática con los genes del MHC. Muchos de los genes reguladores muestran alto polimorfismo y, por ejemplo, variaciones en el gen promotor del factor de necrosis tumoral, y citosinas, tales como receptores de interleucina y γ-interferón, han sido asociadas con enfermedades infecciosas (Sommer, 2005).
Antecedentes
A principios de los 80´s, las dificultades de la reproducción en cautiverio, llevaron hacia investigaciones biomédicas que explicaran la razón de estas. Tanto en poblaciones silvestres como en cautivas, se descubrieron conteos espermáticos relativamente bajos y un nivel de aproximadamente 70% de anormalidades en el desarrollo de espermatozoides (Wildt et al., 1983).
Después de 30 años de intentar la reproducción del guepardo en zoológicos de Norteamérica y Europa, sólo se obtuvo un éxito del 15%. Además, la mortalidad de las crías fue más alta que para otras especies. A pesar de las mejoras en el manejo reproductivo y de comportamiento en guepardos, la baja fecundidad y la alta mortalidad juvenil, tuvo como resultado una población cautiva que no era autosuficiente (Marker & O´Brien, 1989; Marker-Kraus & Grisham, 1993).
Los defectos en los espermatozoides, dieron las pautas para pensar que había una explicación fisiológica para las dificultades reproductivas. Sumado a esto, muchas medidas de diversidad genética, indicaron que las dos subespecies mayores de guepardo (Acinonyx jubatus jubatus de Sudáfrica, y Acinonyx jubatus raineyi del este de África), redujeron notablemente sus valores de variación genética (O´Brien et al., 1987; Yuhki & O´Brien, 1990a; O´Brien, 1994). El resultado de estos estudios demostró que los guepardos tenían niveles de variabilidad genética comparables a los de ratones de laboratorio con altas tasas de endogamia. Estos estudios apoyan la hipótesis de que los antepasados del guepardo habían sobrevivido a un periodo histórico de endogamia extensa (un cuello de botella), teniendo actualmente una reducción de 90-99% en la variación alélica y una notable acumulación de deterioros fisiológicos (O´Brien et al., 1987).
Se sabe que la endogamia puede contribuir a un incremento en la susceptibilidad de una población a las infecciones producidas por distintos patógenos. La interpretación de este fenómeno, involucra un entendimiento de la evolución de la respuesta inmune. Se ha visto que muchos de los loci que median la defensa inmune, dependen de una extensa variación alélica dentro de poblaciones exogámicas, como un “objetivo cambiante” que contrarresta la rápida evolución de los patógenos (O´Brien, 1994).
Por décadas, los guepardos han sido considerados como un ejemplo clásico en la genética de la conservación, debido a su relativamente limitada diversidad genómica observada en loci neutrales como minisatélites, microsatélites y ADN mitocondrial (Menotti-Raymond & O’Brien 1993; Freeman et al. 2001; Driscoll et al., 2002); o loci adaptativos, como aloenzimas y MHC I y II (O’Brien et al., 1983; Yuhki & O’Brien 1990a, Castro-Prieto et al., 2011). Los niveles reducidos de variación genética en guepardos han sido atribuidos a muchos eventos de cuello de botella en la historia de la especie (Menotti-Raymond & O’Brien 1993; Driscoll et al., 2002).
Es razonable asumir que el mantenimiento y la renovación de la variación en las partes funcionales importantes del MHC, tales como los sitios de unión de antígenos, ya sea por mutación, recombinación o inmigración desde otras poblaciones, es un componente genético importante en la cascada conducente a una respuesta inmune adecuada cuando se combaten patógenos nuevos o altamente virulentos. Esto ha sugerido que la extremadamente baja variabilidad en guepardos, como una consecuencia de la depresión endogámica debida a un sustancial cuello de botella hace aproximadamente 10,000 años, limita el proceso de adaptación a patógenos temporales, lo cual podría explicar la alta susceptibilidad a enfermedades (Sommer, 2005).
Enfermedades en cautiverio
Los guepardos en cautiverio tienen altas tasas de morbilidad y mortalidad, debidas principalmente a enfermedades infecciosas, un rasgo que podría ser el resultado de la homogeneidad de la población o los efectos inmunosupresores del estrés crónico (Munson et al., 2004).
Glomeruloesclerosis
Estudios previos han determinado que la mayor causa de muerte de guepardos en cautiverio ha sido el fallo renal resultante de una glomeruloesclerosis. Bolton & Munson (1999), reportaron la presencia de cierto grado de glomeruloesclerosis en el 82% de una población cautiva de 87 individuos; siendo moderada a severa para el 30% de la población. La hiperplasia cortical de las adrenales fue prevalente y estuvo altamente relacionada con la glomerulonefrosis. Algunas razones que pudieron haber propiciado esto serían un hipercorticismo crónico previo o una dieta muy alta en proteína y la pérdida de variabilidad genética de la población.
Amiloidosis sistémica AA
En 141 necropsias realizadas por Papendick et al. (1997) se observó una alta prevalencia de amiloidosis renal (38%) en especímenes de 1 a 16 años. La incidencia aumentó de un 20% en las necropsias realizadas antes de 1990, a un 70% de las necropsias realizadas hasta 1995. En el 74% de los animales con amiloidosis, la insuficiencia renal fue determinada parcial o totalmente como la causa de muerte. Un 52% de los animales con amiloidosis renal presentaron también depósitos amiloides hepáticos. El 100% de los animales presentaba enfermedad inflamatoria (cuadro 1). La enfermedad inflamatoria más común fue la gastritis linfoplasmocítica.
Enfermedad hepática veno-oclusiva
Diversas enfermedades hepáticas de origen desconocido, han sido reportadas como una de las principales causas de muerte de los guepardos en cautiverio. Solamente pocos estudios (3.7%) lograron identificar un virus del tipo de la hepatitis B como causa potencial de la enfermedad No existen reportes de guepardos de vida libre con enfermedad hepática veno-oclusiva (Gosselin et al., 1988).
En su estudio, Gosselin et al. (1988) evaluaron los hígados de 126 especímenes de cautiverio y de otros felinos exóticos, con la finalidad de evaluar si éstas lesiones hepáticas eran vistas exclusivamente en el guepardo, lo cual podría indicar una posible base genética de la enfermedad; también se estudiaron factores alimenticios que pudieran estar involucrados en la patogénesis de esta enfermedad, estimando que altas concentraciones de vitamina A en el hígado, así como en las dietas de los animales, podría contribuir con el desarrollo de la enfermedad veno-oclusiva en algunos grupos de guepardos.
Mielolipoma esplénico
De acuerdo a Cardy & Bostron (1978), la verdadera significancia de esta patología en guepardos aún no está clara, y puede deberse a una respuesta fisiológica o a una neoplasia. La evidencia disponible en ese momento indicaba que la lesión podría ser relativamente común en guepardos (alrededor de 6%).
Helicobacter acinonyx
Se cree que la infección crónica por Helicobacter acinonyx en guepardos, contribuye al desarrollo de gastritis severa, una causa frecuente de morbilidad y mortalidad en individuos de esta especie en cautiverio, pero rara en animales silvestres (Dailidiene et al, 2004; Terio et al. 2005).
En más del 70% de los guepardos que murieron antes de 1995 en Norteamérica, se observó gastritis moderada a severa. Muchos de estos individuos desarrollaron amiloidosis sistémica AA secundaria, resultando en insuficiencia renal y muerte. En la población cautiva de Sudáfrica, la principal causa de muerte fue gastritis, con una prevalencia del 69% (Terio et al., 2005).
En 1990, Eaton et al. (1993) aislaron cuatro cepas de Helicobacter acinonyx a partir de los estómagos de guepardos con gastritis. Posteriormente, Dailidiene et al (2004), reportaron este patógeno en varios felinos, dentro de los que se encontraban seis guepardos pertenecientes a una colección zoológica de Ohio.
En su investigación, Terio et al. (2005), identificaron especies de Helicobacter a partir de 33 muestras gástricas de guepardos infectados (10 provenientes de vida libre, sin gastritis; y 23 de animales en cautiverio, con gastritis), encontrando que estas se asocian con gastritis en los especímenes de cautiverio, pero actúan aparentemente como comensales en los ejemplares silvestres.
Ántrax
Entre los carnívoros silvestres, los guepardos parecen ser inusualmente susceptible al ántrax, y esto ha sido atribuido a la pérdida de su comportamiento carroñero, y por lo tanto, de su habilidad para desarrollar su sistema inmune contra la exposición a carcasas con ántrax (Good et al., 2008).
De manera general, existían pocos reportes de ántrax después de 1973, cuando se vacunaron gran cantidad de animales. Sin embargo, esto cambió cuando se popularizaron los safaris en África, encontrándose casos de esta enfermedad en varias especies de estos lugares, incluyendo un brote que produjo la muerte de 5 guepardos en 1986, aparentemente debida al consumo de una carcasa de babuino (Jäger et al., 1990).
Un nuevo brote de ántrax en la Reserva Jwana, en Botswana, fue observado cuando tres guepardos murieron a causa de esta enfermedad en 2004. Posterior a esto, se realizaron pruebas serológicas a 23 individuos, para evaluar la presencia de anticuerpos contra Bacillus anthrasis; 16 de los 23 ejemplares ingresaban con regularidad a la Reserva. Solamente se detectaron anticuerpos en un guepardo, lo que parece ser la primera demostración de anticuerpos contra ántrax naturalmente adquiridos en un guepardo. Sin embargo, es poco común que los guepardos desarrollen inmunidad natural contra ántrax. Durante este brote, murieron tres animales en cautiverio, que fueron alimentados con cadáveres de la reserva (Good et al., 2008).
Coronavirus
La Peritonitis Infecciosa Felina es una enfermedad fatal inmunomediada de los gatos domésticos y felinos silvestres, como consecuencia de la infección por un coronavirus (Kennedy et al., 2003). A principios de 1982, una epizootia devastadora ocurrió en una colonia de reproducción de guepardos en un safari en Winston, Oregón. Dentro de los siguientes 12 meses, los signos clínicos y la morbilidad fueron aparentes en más del 90% de los guepardos. Entre 1983 y 1987 murieron un total de 27 ejemplares a causa de diversas enfermedades asociadas a coronavirus (Heeney et al., 1990).
Leucemia Viral Felina
Aunque de menor incidencia que otras enfermedades, Marker et al. (2003) describieron el caso de un espécimen nacido en vida libre en Namibia pero mantenido en cautiverio, que presentó un linfoma de células T después de ser mantenido en una exclusa adyacente a la de un animal infectado con el Virus de Leucemia Felina (ViLeF), el cual había estado previamente en contacto con gatos domésticos.
Actualidad
El guepardo ha sido descrito como una especie con bajos niveles de variabilidad genética, como consecuencia de un cuello de botella demográfico 10mil a 12mil años atrás, asumiendo que sólo existen pequeñas diferencias genéticas entre las distintas subespecies descritas (Freeman et al. 2001; Driscoll et al., 2002; Sommer, 2005; Tizard, 2009). Sin embargo, Charruau et al. (2011), encontraron brechas filogeográficas relativamente grandes entre algunas de las poblaciones estudiadas, mediante el análisis de ADN mitocondrial y microsatélites, concluyendo que los guepardos son sumamente vulnerables a la extinción mundial y que se encuentran mayormente amenazados en su rango asiático, donde los últimos 70-110 individuos sobreviven en Irán, los cuales pertenecen a una población monofilética autóctona, conformada por los últimos representantes de la subespecie asiática A. j. venaticus.
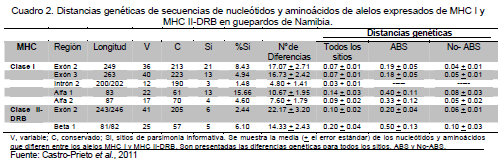
En estudios recientes del MHC, Castro-Prieto et al. (2011) utilizaron métodos moleculares de alta resolución (Polimorfismos de Conformación de Cadena Simple [SSCP], análisis, clonación y secuenciación) en 149 guepardos de Namibia para identificar la diversidad genética en los loci MHC I y MHC II-DRB. Adicionalmente, validaron la expresión de los alelos observados, investigaron la relación filogenética de los alelos del MHC para asignarlos a determinados loci, e hicieron pruebas de selección positiva (Cuadro 2).
Programas de Conservación
La sostenibilidad de las poblaciones, principalmente en los programas de reintroducción, ha sido una consideración importante para la conservación. Es necesario el conocimiento de la especie particular, con el fin de promover la conservación de poblaciones viables a largo plazo.
Elección de pareja y genética de poblaciones: sostenibilidad a largo plazo
En la naturaleza, los guepardos se rigen por una estructura social dominada por las hembras, donde una hembra se aparea con machos diferentes (Gottelli et al., 2007), lo cual debe ser considerado en los programas de reproducción en cautiverio. Permitir a los animales elegir a su pareja reproductiva, puede incrementar las tasas de preñez, tamaño de camada y sobrevivencia de la misma (Cheryl et al., 2011).
Desde el punto de vista genético, permitir la elección de la pareja por parte de los ejemplares, no está libre de riesgos, y puede producir algún problema si son elegidos los animales sobre-representados en la población. Sin embargo, muchos estudios que las hembras tienden a elegir adecuadamente en términos de su propio valor adaptativo y bajo las condiciones en que estos se encuentran viviendo. Por otro lado, tales elecciones en cautiverio podrían no resultar en el mantenimiento de la máxima diversidad genética en la población, representación del equilibrio fundador o evitar la pérdida de adaptaciones al medio ambiente silvestre, que constituyen los principales objetivos en los programas de reintroducción (Cheryl et al., 2011).
Discusión
Cuando un virus cambia genéticamente y vence al sistema inmune de un único individuo, las adaptaciones de este virus no necesariamente serán tan efectivas en otro individuo distinto genéticamente (Sommer, 2005; Tizard, 2009), lo que podría explicar la diversidad genética del MHC, cuya función es reconocer y presentar péptidos virales y otros agentes extraños a los linfocitos T cooperadores.
La baja diversidad genética, particularmente en los loci del MHC, ha sido asociada con una alta susceptibilidad a enfermedades infecciosas en guepardos, lo que según O´Brien (1994) resultó en un 100% de morbilidad y 60% de mortalidad en un brote de Peritonitis Infecciosa Felina en Oregon, a mediados de los 80´s. Sin embargo, cabe destacar que esta es una enfermedad con una alta tasa de morbilidad y mortalidad incluso en gatos domésticos, que poseen una gran diversidad genética en los loci del MHC; además, este brote se dio en condiciones de cautiverio, y no se ha descrito para guepardos silvestres, de acuerdo a lo descrito por Heeney et al. (1990), Munson et al. (2004 y 2005), Thalwitzer et al. (2010) y Castro-Prieto et al. (2011).
La degradación de hábitat y las condiciones climáticas deben ser tomadas en cuenta, ya que cada especie posee adaptaciones de acuerdo a su hábitat. Si este cambia, la transmisión de patógenos puede facilitarse debido a distintos factores, como la presencia de estos en el lugar donde los animales son alojados y la ausencia de los mismos en su rango original de distribución; cambios en la humedad o temperatura, o el hacinamiento, que no se darían de manera natural.
Los primeros estudios del MHC en guepardos, utilizaron métodos indirectos (injertos de piel) o de baja resolución molecular para cuantificar la diversidad del MHC (Análisis de Polimorfismos en la Longitud de los Fragmentos de Restricción [RFLP] de los genes MHC I), así como métodos moleculares de alta resolución, pero con tamaños de muestra muy pequeños (análisis de secuencia de clones del MHC I en dos individuos, análisis conformacional [RSCA] de los genes del MHC II-DRB en 25 individuos; Yuhki & O’Brien 1990b; Freeman et al., 2001). Ha sido controversial hasta qué punto es relevante en la conservación la baja variabilidad genética del MHC (O’Brien, 1994; Castro-Prieto et al., 2011), esto debido a que otros genes podrían estar involucrados en la respuesta inmune. Además, de acuerdo con Tizard (2009), una misma molécula del MHC es capaz de reconocer varios patógenos distintos.
Estudios recientes de seroprevalencia y necropsias realizadas en una población silvestre de guepardos en Namibia, no muestran signos clínicos de enfermedades virales agudas; y muestran un estado general de salud adecuado (Munson et al., 2004, 2005; Thalwitzer et al., 2010); lo que sugiere que la inmunocompetencia de esta población de guepardos no está limitada por su capacidad de responder efectivamente a los cambios virales (Thalwitzer et al., 2010) y que la diferencia observada en inmunocompetencia entre los guepardos silvestres y de cautiverio, puede ser la consecuencia de un manejo inadecuado, resultando en estrés y depresión del sistema inmune (Castro-Prieto et al., 2011).
La cría en cautiverio ha sido originalmente usada como una forma de conservación para la mayoría de las especies seriamente amenazadas, pero es ahora ampliamente usada para la restitución de las poblaciones naturales que han disminuido. En teoría, los individuos criados en cautiverio pueden acumular alelos deletéreos que podrían interferir con la recuperación de las poblaciones silvestres. Sin embargo, hasta qué punto los animales criados en cautiverio contribuyen genéticamente a la restauración de las poblaciones naturales, es todavía desconocido (Araki et al., 2007). Por otra parte, la ocupación de espacios silvestres por individuos criados en cautiverio, podría interferir con la reproducción de los animales originarios del sitio, poniéndolos en una situación de conservación peor que la actual.
Después de analizar 171 muestras fecales, Gottelli et al. (2007) mostraron una alta tasa de paternidad múltiple en la población de guepardos, donde 43% de las camadas con más de una cría, provenían de más de un macho progenitor. Así mismo, se pudo observar que las hembras se aparean con distintos machos durante un mismo ciclo estral, y que los machos que contribuyen sustancialmente a la reproducción de la población, viven fuera del área de la hembra. La estructura social tan peculiar de esta especie, debe ser tomada en cuenta para los programas de conservación, sobre todo cuando se quiere reproducir a estos animales en cautiverio, pues los cambios en la misma pueden ser causa de estrés, lo que tendría consecuencias deletéreas en la reproducción y salud de los mismos.
A pesar de la aparente fortaleza del sistema inmune de los guepardos silvestres de Namibia, todavía existe la duda respecto a si ésta población tiene un nivel más alto de diversidad del MHC que lo observado anteriormente o que lo reportado para otras poblaciones de guepardos (Yuhki & O’Brien 1990b), o si el guepardo, en su medio ambiente natural representa un ejemplo de una especie con baja variabilidad del MHC y además de esto, baja susceptibilidad a enfermedades (Castro-Prieto et al., 2011), o si es simplemente una adaptación a los patógenos de su distribución original, lo que los haría más susceptibles a nuevos organismos al ser trasladados a otros sitios. El papel que juega el estrés en las enfermedades en muchas especies, debería ser también considerado.
Cheryl et al. (2011) describen la importancia de nuevas prácticas de manejo reproductivo para las poblaciones de cautiverio, dentro de las cuales se debe considerar la biología propia de la especie; así mismo, sugieren se permita la elección de pareja por parte de los individuos a reproducir, un criterio muy importante en el éxito reproductivo, ya que aun teniendo la mayor variabilidad genética posible, si los animales no se reproducen, no puede existir un programa de conservación. Por otro lado, promover el conocimiento genético de los animales que ingresarán al programa, solucionaría en parte el problema que una baja diversidad genética pueda causar, introduciendo la mayor diversidad genética posible sin llegar a afectar a la población.
Conclusiones
En relación a lo discutido anteriormente se puede concluir:
- Aunque el MHC es uno de los factores más importantes que ayudan a regular la respuesta del sistema inmune a distintos patógenos, la genética de la conservación debería enfocarse también en el resto de los genes, que podrían estar jugando un papel muy importante en la respuesta inmune de los guepardo.
- Una mayor incidencia de enfermedades en cautiverio pueden deberse a un manejo inadecuado más que a una baja variabilidad del MHC, tal como grupos de cría con pocos machos, o una alimentación inadecuada, estrés, entre otros. Por otro lado, la elevada heterocigosidad, podría estar influyendo en la alta tasa de enfermedades desarrolladas en cautiverio, aunque por causa de genes distintos a los del MHC.
- Es importante realizar estudios de variabilidad genética y susceptibilidad a enfermedades en poblaciones silvestres, ya que éstas pueden diferir enormemente de las cautivas, en las que se basan la mayoría de estudios del MHC y de patologías que afectan a los guepardos.
- Los programas actuales de reproducción en cautiverio están implementando nuevas técnicas que podrían beneficiar las tasas de éxito reproductivo y supervivencia a largo plazo, y por lo tanto la conservación de la especie.
- Introducir animales de genética conocida y diversa a los programas de reproducción en cautiverio, sería de gran ayuda para incrementar dentro de lo posible la genética de estas poblaciones, y por consiguiente la de las poblaciones silvestres en donde estos serán reintroducidos.